Синтез ЦК запрограммирован генетически, кратковременен, регулируется ингибиторами. Повышенное содержание ЦК может быть обусловлено не только увеличением их синтеза, но и нарушением катаболизма, своевременного выведения из организма при поражениях печени, почек.
д.м.н., проф. Царегородцева Т.М., зав. лабораторией иммунологии
ЦНИИ гастроэнтерологии Департамента здравоохранения г. Москвы
Индукторами повышенного синтеза ЦК являются инфекционные микроорганизмы (вирусы, бактерии, паразиты, грибки), продукты их жизнедеятельности, токсины, метаболиты, пищевые, лекарственные, растительные аллергены, а также измененные, модифицированные белки, клетки собственного организма.
ЦК синтезируют активированные клетки, преимущественно лимфоциты, моноциты, тканевые макрофаги. Разные клетки, например макрофаги, лимфоциты, эндотелиоциты, могут синтезировать одни и те же ЦК. С другой стороны, одни и те же клетки могут вырабатывать разные ЦК.
Синтез ЦК запрограммирован генетически, кратковременен, регулируется ингибиторами. Повышенное содержание ЦК может быть обусловлено не только увеличением их синтеза, но и нарушением катаболизма, своевременного выведения из организма при поражениях печени, почек.
Увеличенный синтез ЦК приводит к активации множества самых разных типов клеток. Таким образом, реализуется широкое взаимодействие на субклеточном, клеточном, органном, системном уровнях, формирование комплексной защитной реакции, направленной на нейтрализацию повреждающих агентов, их разрушение, элиминацию из организма, сохранение его гомеостаза, структурной и функциональной целостности.
Классификация цитокинов
В настоящее время идентифицировано более 100 ЦК, и их число продолжает пополняться. Среди ЦК выделяют следующие основные группы: интерлейкины (ИЛ), интерфероны (ИФ), факторы некроза опухоли (ФНО), факторы роста, хемокины и др.
Механизмы действия
Функциональные свойства
ЦК обладают широким спектром биологических свойств: индуцируют и регулируют такие физиологические и патологические процессы как рост, пролиферацию, дифференцировку клеток, метаболизм, воспаление, иммунный ответ. ЦК многофункциональны, универсальны, плейотропны. Одни и те же ЦК могут взаимодействовать с рецепторами разных клеток, при этом ЦК со сходным строением могут оказывать различное биологическое действие, а разные в структурном отношении ЦК — вызывать одинаковый эффект.
Цитокины и воспаление
Цитокины и иммунный ответ
Для определения количественного содержания ЦК в настоящее время широко применяется высокоинформативный метод иммуноферментного анализа с использованием высокочувствительных тест-систем, в т.ч. и отечественного производства.
Результаты многолетних исследований, проводимых в ЦНИИ гастроэнтерологии, позволили выявить особенности изменения цитокинового статуса при ЗОП в зависимости от этиологического фактора, вариантов течения, стадии, продолжительности заболевания, проводимой терапии.
Этиологический фактор оказывает существенное влияние на уровень циркулирующих ЦК при ЗОП. Так, повышение содержания ЦК при хронических инфекционных, воспалительных, аутоиммунных заболеваниях более выражено, нежели при злокачественных новообразованиях, нарушениях обмена, наследственных поражениях.
Роль цитокинов в диагностике заболеваний органов пищеварения
Цитокинотерапия
Достижения современной молекулярной биологии, биотехнологии, иммунологии, генетики в изучении структурной организации, функциональных свойств ЦК служат основанием для их использования с терапевтической целью при заболеваниях разных органов и систем.
Мощным активатором естественной резистентности являются препараты ИНФ-α, индукторы его синтеза (циклоферон, амиксин), стимулирующие неспецифическую защиту, цитотоксическую, фагоцитарную активность, способствуя тем самым разрушению и удалению из организма инфицированных, опухолевых и других дефектных клеток.
Таким образом, применение ЦК, их индукторов, ингибиторов сопровождается улучшением показателей клинико-лабораторной активности, снижением интенсивности воспалительных, иммунопатологических реакций при хронических ЗОП, однако позитивный эффект носит временный характер.
Заключение
Определение цитокинового статуса имеет важное прогностическое значение, поскольку позволяет судить об интенсивности воспалительных, инфекционных, иммунопатологических процессов, их динамике, прогрессировании ЗОП, а также эффективности проводимой терапии.
Литература
1. Ляшенко А.А., Уваров В.Ю. К вопросу о систематизации цитокинов// Успехи современной биологии.- 2001.- 121.- № 6.- С. 589–603.
2. Черешнев В.А., Гусев Е.И. Иммунология воспаления: роль цитокинов// Мед. иммунология.- 2001.- т. 3.- № 3.- С. 361–368.
3. Ройт А., Бростофф Дж., Мейл Д. Иммунология.- М.: Мир, 2000.- С. 169–175.
4. Адлер Гвидо. Болезнь Крона и язвенный колит.- М.: Медицина, 2001.- 64 с.
5. Андерсен Л., Норгард А., Беннедсен М. Клеточный иммунный ответ на инфекцию Н.р./ В кн.: Нelicobacter рylori: революция в гастроэнтерологии.- М., 1999.- С. 46–53.
6. Астахин А.В., Левитан Б.Н., Дудина О.С. и соавт. Регуляторные цитокины сыворотки крови при хронических гепатитах и циррозах печени// Рос. журн. гастроэнтерол., гепатол., колопроктол.- 2002.- 12.- 5.- С. 80.
7. Гудкова Р.Б., Жукова С.Г., Крумс Л.М. Сывороточные цитокины при глютеновой энтеропатии// Рос. гастроэнтер. журн.- 2001.- № 2.- С. 121.
8. Жукова Е.Н. Сывороточный интерлейкин 8 в различные периоды течения хронического рецидивирующего панкреатита и его участие в патогенезе заболевания// Росс. гастроэнтерол. журн.- 2000.- № 1.- С. 15–18.
9. Кондрашина Э.А., Калинина Н.М., Давыдова Н.И., Барановский А.Ю., Кондрашин А.С. Особенности цитокинового профиля у пациентов с хроническим H. pylory-ассоциированным гастритом и язвенной болезнью// Цитокины и воспаление.- 2002.- т. 1.- № 4.- С. 3–11.
10. Лазебник Л.Б., Царегородцева Т.М., Серова Т.И. и соавт. Цитокины и цитокинотерапия при болезнях органов пищеварения// Тер. арх.- 2004.- № 4.- С. 69–72.
11. Царегородцева Т.М., Серова Т.И. Цитокины в гастроэнтерологии.- М.: Анахарсис, 2003.- 96 с.
12. Царегородцева Т.М., Винокурова Л.В., Живаева Н.С. Цитокиновый статус при хроническом панкреатите алкогольной и билиарной этиологии// Тер. арх.- 2006.- № 2.- С. 57–60.
13. Логинов А.С., Царегородцева Т.М., Серова Т.И. и соавт. Интерлейкины при хроническом вирусном гепатите// Тер. арх.- 2001.- № 2.- С. 17–20.
14. Павленко В.В. Интерлейкин-1b и регенераторная активность слизистой оболочки толстого кишечника при язвенном колите// Рос. журн. гастроэнтер., гепатол., колопроктол.- 2002.- т. ХII.- № 5.- С. 58.
15. Семененко Т.А. Клеточный имунный ответ при гепатите С// Вирусные гепатиты.- 2000.- № 1.- (8).- С. 3–9.
16. Соколова Г.Н., Царегородцева Т.М., Зотина М.М., Дубцова Е.А. Интерлейкины при язвенной болезни желудка и 12-перстной кишки// Рос. гастроэнтерол. журн.- 2001.- № 2.- С. 147–148.
17. Ткаченко Е.И., Еремина Е.И. Некоторые комментарии к современному состоянию проблемы язвенной болезни// Гастроэнтерология.- СПб.- 2002.- № 1.- С. 2–5.
18. Трухан Д.И. Клинико-иммунологические варианты течения хронического панкреатита// Тер. арх.- 2001.- № 2.- С. 20–23.
19. Шерлок Ш., Дулли Дж. Заболевания печени и желчных путей. М.: Медицина, 1999.- С. 92–95.
20. Шичкин В.П. Патогенетическое значение цитокинов и перспективы цитокиновой/антицитокиновой терапии// Иммунология.- 1998.- № 2.- С. 9–13.
21. Змызгова А.В. Интерферонотерапия вирусных гепатитов.- М., 1999.
22. Долгушина А.И. Бета-лейкин в лечении язвенной болезни// Цитокины и воспаление.- 2002.- т. 1.- № 2.- С. 34.
23. Москалев А.В., Голофеевский В.Ю., Ботиева В.И. и соавт. Коррекция бета-лейкином нарушений цитокинового статуса у больных с хроническими эрозиями желудка// Гастроэнтерология.- СПб.- 2003.- № 2.- 3.- С. 110.
24. Панина А.А., Антонов Ю.В., Недогода В.В. Опыт применения ронколейкина у больных хроническим вирусным гепатитом В// Мед. иммунология.- СПб.- 2002.- 4.- 2.- С. 370–371.
25. Скляр Л.Ф., Маркелова Е.В. Цитокинотерапия рекомбинантным интерлейкином 2 (Ронколейкином) больных хроническим вирусным гепатитом С// Цитокины и воспаление.- 2002.- т. 1.- № 4.- С. 43–46.
26. Ильченко Л.Ю., Царегородцева Т.М. Интерфероны и интерферонотерапия при хронических вирусных гепатитах// Эксперим. и клинич. гастроэнтерол.- 2003.- № 1.- С. 126.
27. Маммаев С.Н., Лукина Е.А., Ивашкин В.Т. и соавт. Продукция цитокинов у больных хроническим вирусным гепатитом С на фоне терапии интерферономa// Клинич. лаборат. диагностика.- 2001.- № 8.- С. 45–47.
28. Panaccione R., Ricart E., Sandborn W.J. et al. Infliximab for Crohn`s disease in clinical practice at the Mayo Clinic// Am..J.Gastroenterol..- 2001.- 96.- P. 722–729.
29. Sandborn W.J., Hanauer S.B. Infliximab in the treatment of Chrohn`s Disease// Am.J.Gastroenterol.- 2002.- v. 97.- № 12.- P. 2962–2972.
30. Tremaine W.I., Sands B.E., Rutgeerts P.J. et al. Infliximab in the treatment of severe, steroid-refractory ulcerative colitis// J.B.D.- 2001.- 7.- P. 83–88.
31. Wagner C., Cornillie F., Shealy D. et al. Infliximab induced potent antiflammatory and local immunomodulatory activity but no systemic immune supression in patients with Crohn`s disease// Aliment. Pharmacol. Ther.- 2001.- 15.- P. 463–473.
32. Белоусова Е.А. Инфликсимаб — новый этап в лечении болезни Крона// Фарматека.- 2002.- № 9.- С. 17–25.
На видеоролике внизу главный пульмонолог Забайкальского края Сергей Лукьянов показывает лёгкие умершей пациентки. Белые пятна на чёрном фоне — поражённые участки.
Кто такие цитокины и почему нам нужно это знать
На видеоролике внизу главный пульмонолог Забайкальского края Сергей Лукьянов показывает лёгкие умершей пациентки. Белые пятна на чёрном фоне — поражённые участки.
Такое лёгкое не может принимать участие в газообмене, человек задыхается. Так называемый синдром булыжной мостовой — двусторонняя субтотальная пневмония, и мы видим, что в задних отделах лёгкие поражены тотально. Человек с такими лёгкими не может жить, не может дышать
Главный пульмонолог Забайкальского края
По данным медиков, цитокиновый шторм бывает в среднем у 75 человек на каждые 100 тысяч населения. И это считается довольно высоким показателем для такого опасного синдрома. При этом летальный исход по статистике — в 40–60%, то есть в половине случаев.
Когда бывает цитокиновый шторм
Список того, что может спровоцировать такую неконтролируемую реакцию иммунитета, довольно обширен. На первом месте в нём, конечно же, инфекции. И вирусные, и бактериальные. Кстати, известно, что вирусные часто сопровождаются бактериальными. Кроме того, цитокины могут сойти с ума в результате черепно-мозговой или какой-то другой серьёзной травмы, шокового состояния.
То, что мы знаем о цитокиновом шторме, хорошо согласуется с тем, что пишут о своём опыте врачи, работающие с ковидными больными: очень важно вовремя его «поймать», потому что, если в ответ на гиперпродукцию интерлейкина-6 (разновидность цитокинов. — Прим. Лайфа) начали выделяться другие цитокины, его блокировка уже не помогает
Главный научный сотрудник Института молекулярной биологии им. Энгельгардта РАН
Как рассказал в своей лекции профессор МГМСУ им. А.И. Евдокимова Андрей Малявин, лучший способ вовремя заметить неадекватное поведение цитокинов — регулярно измерять уровень насыщения крови кислородом. Для этого есть специальный прибор — пульсоксиметр. По словам учёного, если аппарат показывает меньше 95% — это основание для госпитализации.
Чем лечат цитокиновый шторм
Профессор Малявин считает самой правильной следующую тактику. Первое — метилпреднизолон. Это гормональный препарат с противовоспалительным, противошоковым, антиаллергическим и иммунодепрессивным действием, то есть он подавляет иммунитет.
Я плохо представляю себе терапию ОРДС без гормональных препаратов
Профессор кафедры пульмонологии МГМСУ им. А.И. Евдокимова
Далее — вентиляция лёгких. При этом учёный подчеркнул, что выступает за неинвазивную вентиляцию, то есть за мобильные аппараты для поддержки дыхания. Он считает, что прибегать к помощи аппаратов ИВЛ нужно только в самом крайнем случае.
Надо сказать, что метилпреднизолон часто назначают при артритах. И всё больше медиков склоняются к тому, что именно такие лекарства могут оказаться полезными для борьбы с CoViD-19. Глава Минздрава Михаил Мурашко в эфире Первого канала упомянул, что в России зарегистрировали и начали применять новый отечественный препарат для профилактики цитокинового шторма. Правда, какой именно — не уточняется.
Один из препаратов, который профилактирует цитокиновый шторм, поражение лёгких, зарегистрирован на прошлой неделе и уже вошёл в клиническую практику, причём это отечественный препарат. Ещё один препарат противовирусный, я воздержусь просто пока называть, на этой неделе завершат исследование
Министр здравоохранения РФ
Однако ранее российская биотехнологическая компания «Биокад» сообщила, что министерство дало разрешение на клинические испытания «Левилимаба» — препарата, изначально разработанного для лечения ревматоидного артрита.
Механизм действия активного вещества («Левилимаба» . — Прим. Лайфа) связан с цитокиновым штормом, опасной для жизни реакцией иммунной системы, встречающейся у пациентов с CoViD-19
Из публикации на сайте компании
Между тем в Институте молекулярной биологии им. Энгельгардта РАН рассказали о работе над комплексной терапией цитокинового шторма. Учёные намерены испытать её на генно-модифицированных («гуманизированных») лабораторных мышах — некоторые их гены заменены на человеческие. По словам учёных, с помощью грызунов они пытаются найти эффективный способ блокировать действие интерлейкина-6 — это один из главных цитокинов.
На них коллеги видят совместный эффект антиинтерлейкина-6 (тоцилизумаба) и анти-ФНО (аналог инфликсимаба, лекарства от ревматоидного артрита) при лечении экспериментального воспаления лёгких при астме. Но там не доходит дело до цитокинового шторма, эту модель надо ещё доработать. В частности, если думать о коронавирусе, то нужно «гуманизировать» также рецептор ACE2 — таких мышей коллеги и за границей планируют купить, и своих сделать, но это всё займёт ещё довольно много времени
Главный научный сотрудник Института молекулярной биологии им. Энгельгардта РАН
Вышеупомянутый тоцилизумаб — это иммунодепрессант, который тоже назначают при артритах. Сейчас его по всему миру исследуют как лекарство от цитокинового шторма на фоне коронавируса.
Тоцилизумаб и другие блокаторы интерлейкина-6 при правильном применении дают очень хорошие результаты
Главный научный сотрудник Института молекулярной биологии им. Энгельгардта РАН
У микробиологов есть и другие предложения. К примеру, в Университете Джонса Хопкинса заинтересовались празозином — это препарат для лечения сердечной недостаточности, он расширяет кровеносные сосуды. Учёные заявили, что в эксперименте на мышах средство показало эффективность в предотвращении чрезмерного воспаления и, как следствие, цитокинового шторма.
Главный научный сотрудник Института молекулярной биологии им. Энгельгардта РАН
Японские исследователи в свою очередь заявили, что поняли механизм цитокиновой стихии при коронавирусе: по их словам, проникновение SARS-CoV-2 в клетку организма заражённого вызывает повышенную выработку особого гормона, который и вызывает воспаление в кровеносных сосудах и других тканях. Так что они призывают создать лекарство против этого гормона. Однако все эти варианты, к сожалению, пока существуют лишь гипотетически.
Больше интересного из мира науки и технологий — в телеграм-канале автора.
Авторы, желающие опубликовать статьи в журнале, могут присылать рукописи на любой из следующих электронных адресов: (главному редактору Петру Григорьевичу Назарову) или (зав. редакцией Ольге Ярославовне Михайловой).
| Ершов Ф.И., действ.чл. РАМН, Москва Калинина Н.М., д.м.н., проф., Санкт-Петербург Караулов А.В., чл.-корр. РАМН, Москва Киселев О.И., действ. чл. РАМН, Санкт-Петербург Маянский А.Н., д.м.н., проф., Нижний Новгород Нагорнев В.А., действ. чл. РАМН, Санкт-Петербург Насонов Е.Л., действ. чл. РАМН, Москва Петров Р.В., действ. чл. РАН и РАМН, Москва Полевщиков А.В., д.б.н., проф., Санкт-Петербург |
Сапронов Н.С., чл.-корр. РАМН, Санкт-Петербург Сенников С.В., д.м.н., проф., Новосибирск Симбирцев А.С., д.м.н., проф., Санкт-Петербург Фрейдлин И.С., чл.-корр. РАМН, Санкт-Петербург Хаитов Р.М., действ. чл. РАН и РАМН, Москва Черешнев В.А., действ. чл. РАН и РАМН, Екатеринбург Ширинский В.С., д.м.н., проф., Новосибирск Шишкин В.И., д.м.н., проф., Санкт-Петербург Ярилин А.А., д.м.н., проф., действ. чл. РАЕН, Москва |
Активированные макрофаги наряду с ИЛ-1 и ИЛ-8 вырабатывают также ИЛ-6, ИЛ-12 и ФНО-а.
В зависимости от воздействия на воспалительный процесс цитокины подразделяются на две группы — провоспалительные (ИЛ-1, ИЛ-6, ИЛ-8, ФНО-а, ИЛ-12) и противовоспалительные (ИЛ-4, ИЛ-10, ТФР-(5).
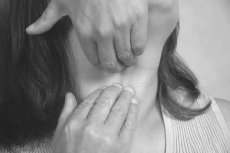
Основные типы клеток, участвующих в развитии местной воспалительной реакции, — нейтрофилы, моноциты, макрофаги, а также клетки эндотелия и фибробласты. Первыми на внедрение инфекционного агента реагируют ДК и макрофаги.
Защита на местном уровне происходит за счет формирования типичной воспалительной реакции с ее классическими проявлениями: развитием
ИЛ-4/ИЛ-13
Альтернативная активация макрофагов, выробатка 1дЕ плазматическими клетками, активация эпителиальных и гладкомышечных клеток
Привлечение и активация эозинофилов, выроботка 1дА плазмоцитами
Привлечение и активация тучных клеток и базофилов
Гладкомышечная клетка Рис.
Одновременно провоспалительные цитокины активируют метаболизм соединительной ткани, стимулируют пролиферацию фибробластов и клеток эпителия, что чрезвычайно важно для заживления повреждений и восстановления целостности ткани. Таким образом, на местном уровне цитокины отвечают за все последовательные этапы развития адекватного ответа на внедрение патогена, его локализацию и удаление, а затем — за восстановление поврежденной структуры тканей.
«Узнавание» патогена макрофагами и нейтрофилами происходит при участии ТЬК. Это один из возможных вариантов индукции воспалительного процесса. В первые 24 ч в очаге воспаления преобладают нейтрофилы, затем доминируют моноциты и макрофаги.
Под влиянием ИЛ-1 возрастает концентрация продуктов метаболизма фосфолипидов (простагландины, тромбоксан и тромбоцитактивирующий фактор) в клетках воспалительного экссудата. Это вызывает расширение стенок кровеносных сосудов (вазодилатацию). В костном мозге возрастает число гранулоцитов, рециркулирующих в зону воспаления. Нейтрофилы из циркуляции поступают в очаг воспаления.
Активированные макрофаги наряду с ИЛ-1 и ИЛ-8 вырабатывают также ИЛ-6, ИЛ-12 и ФНО-а.
ФНО-а — важный провоспалительный цитокин. Под действием этого фактора:
• увеличивается количество молекул агдезии на эндотелиальных клетках сосудов, что способствует привлечению лейкоцитов в очаг воспаления;
• происходит активация клеток, участвующих в воспалительной реакции;
• увеличивается количество молекул главного комплекса гистосовместимости на поверхности инфицированных клеток, что способствует их разрушению цитотоксическими клетками.
При контакте с микроорганизмами цитокины могут выделять и другие клетки: ЫК-клетки и Т-лимфоциты — ИФН-у, базофилы — ИЛ-4.
В печени под влиянием цитокинов усиливается синтез белков острой фазы и компонентов системы комплемента, необходимых для борьбы с патогеном, однако одновременно ослабевает интенсивность синтеза альбумина. Другой пример избирательного действия цитокинов — изменение ионного состава плазмы крови при развитии системной воспалительной реакции.
Цитокины — система, формирующая и регулирующая весь комплекс защитных реакций организма при внедрении патогенов. Гиперпродукция
Каскад провоспалительных цитокинов
Миграция нейтрофилов и моноцитов из крови в ткани.
Активация фагоцитоза. Генерация активных форм кислорода и ЫО-радикалов макрофагами.
Рис. 3-33. Эффекты провоспалительных цитокинов в зависимости от их концентрации [Ковальчук Л.В. и др., 2001].
В клинической практике используют: 1) рекомбинантные препараты рецепторного антагониста ИЛ-1 (препарат арил); 2) рекомбинантные растворимые рецепторы ФНО-КН (этанерцепт); 3) гуманизированные моноклональные антитела к ФНО-а (ремикейд, инфликсимаб).
На кефедре иммунологии ГОУ ВПО «РГМУ» разработана новая технология, получившая название персонифицированной иммунотерапии, основанная на локальном применении комплекса аутологичных цитокинов, выделяемых из лейкоцитов пациента. Этот метод позволяет избежать развития побочных реакций и обладает высокой эффективностью в лечении широкого спектра заболеваний, сопровождающихся воспалением, нарушением репарации и развитием вторичного иммунодефицита.
Вопросы для самоконтроля
• В чем заключаются принципиальные различия стратегии распознавания патогенов системой врожденного и адаптивного иммунитета?
• Охарактеризуйте основные рецепторы системы врожденного иммунитета.
• Опишите строение антигенраспознающих рецепторов Т- и В-лимфоцитов. Что общего в структуре этих рецепторов? Назовите основные различия.
• Опишите строение ТЬК, их экспрессию на клетках иммунной системы.
• В чем состоят различия в экспрессии и проведении сигналов с ТЬК, распознающих вирусные и бактериальные антигены?
• Какое клиническое значение имеет изучение системы ТЬК? Перечислите возможные уровни дефектов в системе ТЬК.
• Каковы основные особенности распознавания антигенов Т- и В-лимфоцитами?
• Опишите особенности презентации и распознавания бактериальных и вирусных антигенов.
• Что такое иммунологический синапс?
• Каковы основные этапы антигеннезависимой дифференцировки Т-лимфоцитов в тимусе?
•  Опишите основные стадии дифференцировки В-лимфоцитов.
Опишите основные стадии дифференцировки В-лимфоцитов.
• Дайте определение цитокинов. Охарактеризуйте их основные свойства.
• Сформулируйте представление о системе цитокинов. Укажите значение цитокинов для клинической иммунологии.
• Охарактеризуйте основные клетки, продуцирующие цитокины.
• Какую роль играют цитокины в воспалении?
• Объясните роль цитокинов в патогенезе заболеваний. Цитокинзави- симая патология.
Цитокиновый шторм — это ситуация, когда вырабатывается большое количество цитокинов , что ведет к излишне бурной активации воспаления и иммунным сбоям. При ковиде именно вирус запускает этот процесс. Основным корабликом, который перемалывает шторм, становятся легкие. Но попутно могут страдать и близлежащие острова: сердце, почки, кишечник, селезенка, центральная нервная система.
Терапия
- Лечение гидроксихлорахином не оправдано при тяжелых и крайне тяжелых формах ковида (в том числе при цитокиновом шторме), так как его вред для сердца в высоких дозах сведет на нет всю пользу от подавления излишнего иммунитета.
- Возможно использование антиковидной плазмы в первую неделю от развития симптомов респираторного дистресс-синдрома.
- Препарат выбора для подавления высокой реактивности иммунной системы — глюкококртикоид. Метилпреднизолон или дексаметазон внутривенно позволяют вести лечение цитокинового шторма. В дальнейшем переходят на поддерживающие дозы в таблетках. Глюкокортикоиды сочетают с непрямыми антикоагулянтами.
- Профилактика полиорганной недостаточности на фоне цитокинового шторма ведется ингибиторами интерлейкинов (тоцилизумабом, сарилумабом или канакинумабом).
- Для быстрого купирования цитокинового шторма тоцилзумаб назначается внутривенно совместно с глюкокортикоидом.
- Инфузионная терапия (10-15 мл/кг в сутки) в ОРИТ, кислородотерапия в прон-позиции (лежа на животе) по 12-16 часов в сутки, ИВЛ по показаниям (два любых признака из трех: нарушение сознания; сатурация 35 в минуту).
Как избежать цитокинового шторма? Не заниматься самолечением на дому, при подозрении на ковид или его симптомах, обратиться за квалифицированной медицинской помощью, выполнять рекомендации лечащего врача.
В развитии и функционировании нейтрофилов можно выделить три стадии, когда наблюдаются наиболее существенные различия по готовности клеток к реализации процесса апоптоза: 1) созревание в костном мозге; 2) пребывание в циркуляции; 3) нахождение в тканях, в том числе сюда необходимо отнести и экссудативные нейтрофилы (саливарные, перитонеальные, раневые, интраназальные, вагинальные, бронхоальвеолярные) [22,23].
Цель обзора. Рассмотреть некоторые приоритетные патогенетические механизмы формирования хронической обструктивной болезни легких.
Основные положения. Продемонстрировать приоритетное действие цитокинов в очаге воспаления и на территории реагирующих лимфоидных органов, а также связь реализации неспецифических и специфических иммунных реакций при хронической обструктивной болезни легких (ХОБЛ) с влиянием на различные гомеостатические системы организма целого ряда универсальных медиаторов, среди которых особое место занимает цитокиновая сеть, контролирующая процессы реализации иммунной и воспалительной реактивности.
Заключение. Изучение хронического альвеолярного/бронхиального воспаления является ключевым фактором в развитии теории патогенеза многих легочных патологий.
Цитокины – это гормоноподобные белки, вырабатываемые различными клетками (лимфоцитами, моноцитами, гранулоцитами, мастоцитами, эндотелиоцитами, фибробластами, и др. клетками), обладающие широким спектром биологической активности, осуществляющие межклеточные взаимодействия при гемопоэзе, иммунном и воспалительном ответах, межсистемных взаимодействиях [15-18].
Цитокины традиционно делят на интерлейкины (Ил-1 – ИЛ-15), факторы некроза опухоли (TNF-альфа и -бетта), фактор, ингибирующий миграцию, интерфероны, хемотаксические факторы, ростовые факторы (фактор роста фибробластов, трансформирующий фактор роста – ТФР-бетта, эпителиалные и эндотелиальные факторы роста и т.д.) [7,8,19,20].
В развитии и функционировании нейтрофилов можно выделить три стадии, когда наблюдаются наиболее существенные различия по готовности клеток к реализации процесса апоптоза: 1) созревание в костном мозге; 2) пребывание в циркуляции; 3) нахождение в тканях, в том числе сюда необходимо отнести и экссудативные нейтрофилы (саливарные, перитонеальные, раневые, интраназальные, вагинальные, бронхоальвеолярные) [22,23].
Таким образом, активация системы цитокинов у больных ХОБЛ является маркером прогрессирования заболевания с вовлечением в патогенез все новых и новых составляющих, включая нейрогуморальную систему организма человека, приводящую к появлению и прогрессированию ЛГ, что требует особой фармакотерапевтической тактики в ведении этих больных [6].
Альвеолярные макрофаги гиперпродуцируют ряд биологически активных веществ, в том числе интерлейкин-1, который стимулирует Т-лимфоциты и привлекает их в очаг воспаления, т.е. интерстициальную ткань легких и альвеолы [26].
Т-лимфоциты распознают инфицированный макрофаг по экспонированию на его поверхности микробного антигена, находящегося в комплексе с гликопротеином МНС класса II, который в данном случае служит сигналом макрофага. В результате распознавания Т-клетки выделяют лимфокины, стимулирующие внутриклеточное уничтожение возбудителя макрофагом.
Таким образом, терапия, направленная на коррекцию моноцитарно-макрофагальной системы, является приоритетной у больных, имеющих воспалительную природу заболевания, на всех этапах воспалительного процесса и независимо от его локализации, как в бронхолегочной системе, так и в других.
Известно, что коварство ХОБЛ заключается в медленном, но неуклонном прогрессировании. Выраженная клиническая симптоматика появляется лишь в развернутой стадии болезни (2 стадия). На ранних стадиях ХОБЛ протекает скрыто, без постоянных клинических симптомов.
Совершенствование наших представлений о сущности заболевания – патогенеза ХОБЛ – является важнейшим инструментом, влияющим на основные подходы к классификации ХОБЛ, лечнению и профилактике заболевания.
С ХОБЛ нужно и можно бороться. Существуют лечебные мероприятия, способные уменьшить симптомы болезни, замедлить ее прогрессирование и улучшить качество жизни пациентов.
Характерный симптом – увеличение размеров шеи за счет отека подкожной жировой клетчатки, который связан с резким повышением сосудистой проницаемости. Некоторые больные жалуются на ноющие или тупые боли в пояснице, уменьшение объема мочеиспускания. Возможны кожные высыпания. У части пациентов развивается спутанность сознания, галлюцинации, эпилептиформные припадки.
Лечение цитокинового шторма
Все больные должны быть госпитализированы в палату интенсивной терапии либо реанимационное отделение. При низком уровне сатурации проводится подключение пациента к искусственной вентиляции легких. Для снижения частоты летальных исходов, независимо от причины, используются следующие лекарственные средства, позволяющие уменьшить степень выраженности цитокинового шторма:
Следует помнить, что данные препараты оказывают ингибирующее действие на несколько звеньев иммунной системы, поэтому их применение ассоциировано с повышением риска присоединения вторичной инфекции, чаще всего бактериальной. Помимо «антицитокинового лечения» проводится следующая терапия:
Действие провоспалительных цитокинов на ЦНС.Цитокины действуют на центр терморегуляции, вызывая повышение температуры, что является эффективной защитной реакцией организма, поскольку при высокой температуре уменьшается способность бактерий к размножению, однако увеличивается пролиферативная активность иммунных клеток. Высокие концентрации цитокинов снижают аппетит, изменяют поведенческие реакции.
Цитокины в зависимости от действия на воспалительный процесс подразделяются на 2 группы – провоспалительные (ИЛ1, ИЛ6, ФНОα, ИЛ17, ИЛ18) и противовоспалительные(ИЛ4, ИЛ10, ТФРβ).
На локальном уровне при действии патогенов или повреждающих факторов формируется типичная воспалительная реакция с ее классическими проявлениями: развитием отека, покраснения, появлением болевого синдрома. Развитие местной воспалительной реакции опосредуют нейтрофилы, моноциты, макрофаги, а также клетки эндотелия и фибробласты.
В то же время провоспалительные цитокины активируют метаболизм соединительной ткани, стимулируют пролиферацию фибробластов и клеток эпителия, что важно для заживления. При избыточной секреции провоспалительных цитокинов и поступлении их в кровь реализуются системные эффекты.
Действие провоспалительных цитокинов на ЦНС.Цитокины действуют на центр терморегуляции, вызывая повышение температуры, что является эффективной защитной реакцией организма, поскольку при высокой температуре уменьшается способность бактерий к размножению, однако увеличивается пролиферативная активность иммунных клеток. Высокие концентрации цитокинов снижают аппетит, изменяют поведенческие реакции.
Агрессивный цитокиновый ответпри ряде инфекций представляет большую проблему, нежели сама инфекция. Так у пациентов с молниеносной грамотрицательной инфекцией развивается сепсис, приводящий к шоку и полиорганной недостаточности. В связи с этим исследование регуляции провоспалительных цитокинов и применение антицитокиновых препаратов имеют большое значение.
В числу основных провоспалительных цитокинов относят:
Особенности цитокинов
Основные характеристики цитокинов:
- избыточность – способность производить тот же эффект
- плиотропия – способность влиять на различные типы клеток и вызывать в них различные действия
- синергизм – взаимодействие
- индукция положительных и отрицательных каскадов обратной связи
- антагонизм – взаимная блокировка эффектов действия
Запрос на квитанцию об оплате присылайте на e-mail: cytokines yandex.ru.
Контакты
E-mail для научной переписки: pnazarov pn4093.spb.edu, cytokines_inflammation yahoo.com Телефон: (812) 234 16 69, факс: (812) 234 94 89
Заведующая редакцией журнала «Цитокины и воспаление» Михайлова Ольга Ярославовна E-mail: cytokines yandex.ru Тел.: + 7 (921) 984 11 30 Адрес для почтовых отправлений:
197376, Санкт-Петербург, ул. акад. Павлова, д. 12, ГУ НИИЭМ РАМН Лаборатория общей иммунологии, главному редактору журнала «Цитокины и воспаление» профессору Петру Григорьевичу Назарову
В 2004 году журнал включен в Реферативный журнал и Базы данных ВИНИТИ . Сведения о журнале ежегодно публикуются в международной справочной системе по периодическим и продолжающимся изданиям «Ulrich’s Periodicals Directory» .
| Бережная Н.М. (Киев) Бубнова Л.Н. (Санкт-Петербург) Ветлугина Т. П. (Томск) Горланов И.А. (Санкт-Петербург) Ищенко А.М. (Санкт-Петербург) Козлов В.К. (Санкт-Петербург) Коненков В.И. (Новосибирск) Мазуров В.И. (Санкт-Петербург) Маркелова Е.В. (Владивосток) Машко С.В. (Москва) Медуницын Н.В. (Москва) Недоспасов С.А. (Москва) Нежинская Г.И. (Санкт-Петербург) Нестеренко В.Г. (Москва) Нестерова И.В. (Москва) | Панарин Е.Ф. (Санкт-Петербург) Пинегин Б.В. (Москва) Потапнев М.П. (Минск) Пуринь В.И. (Санкт-Петербург) Саватеева Т.Н. (Санкт-Петербург) Селедцов В.И. (Калининград) Сепиашвили Р.И. (Москва) Серебряная Н.Б. (Санкт-Петербург) Сесь Т.П. (Санкт-Петербург) Сизякина Л.П. (Ростов-на-Дону) Суховей Ю.Г. (Тюмень) Тотолян Арег А. (Санкт-Петербург) Хавинсон В. Х. (Санкт-Петербург) Черных Е.Р. (Новосибирск) |
В 2004 году журнал включен в Реферативный журнал и Базы данных ВИНИТИ . Сведения о журнале ежегодно публикуются в международной справочной системе по периодическим и продолжающимся изданиям «Ulrich’s Periodicals Directory» .
Журнал распространяется по всем регионам России, СНГ и Балтии по подписке через агентства «Интер-Почта-2003», через издательство «Цитокины и воспаление», через сеть магазинов Медицинская книга, на конференциях и медицинских выставках в Санкт-Петербурге и Москве.
Подписаться на журнал «Цитокины и воспаление» можно на нашем сайте через «Стол заказов», или связавшись с нами по электронной почте или телефону.
Вся информация о журнале на сайте, в том числе статьи, разбита по разделам:
- О журнале — данная страница.
- Номера за 2020 год — общий раздел для номеров, вышедших в этом году.
- Архив журнала — общий раздел для всех старых номеров.
- Рубрики журнала — в этом разделе статьи сгруппированы по рубрикам.
- Правила для авторов — информация для авторов, желающих опубликовать свои работы в журнале «Цитокины и Воспаление».
- О подписке — подробная информация о подписке на журнал «Цитокины и воспаление».
Авторы, желающие опубликовать статьи в журнале, могут присылать рукописи на любой из следующих электронных адресов: (главному редактору Петру Григорьевичу Назарову) или (зав. редакцией Ольге Ярославовне Михайловой).

Обновление на книжной полке:
компакт-диск Цитокины и воспаление, 2008 год.
Цитокины ( интерлейкины , хемокины , лимфокины , монокины , интерфероны ) являются важнейшими факторами регуляции защитных реакций человека, в том числе реакций воспаления и иммунитета, и относятся к числу наиболее активно изучаемых биологически активных молекул.